세포치료제(Cell Therapy), 유전자치료제(Gene Therapy)는 재조합 단백질(1세대), 항체 (2세대) 제품군을 이을 차세대 바이오 의약품으로 일찍부터 주목받아 왔다.
세포치료제
세포치료제는 살아있는 세포를 치료에 이용하는 것이다.
1990~2000년대에 허가받은 세포치료제 는 주로 피부세포나 연골세포를 이용한 피부재생·연골결손 치료제였으나, 최근에는 암, 퇴행성 질환을 타깃으로 하는 줄기세포 및 면역세포에 대한 연구가 활발해지면서 이들 이 개발의 중심에 자리잡고 있다. 오늘은 면역세포치료에 대해 알아보겠다.
면역세포치료제(Immune cell therapy)
체내의 면역세포를 채집하여 강화시키거나 유전공학적으로 변형시켜 다시 넣어주는 세포치료 방식이다.
이를 적응(입양)세포치료(adoptive cell transfer, ACT)라 하는데, 대표적으로 암세포에 대한 세포성 면역을 강화시키는 방법으로 종양침윤림프구(tumor infiltrating lymphocytes, TIL), T 세포 수용체(T cell receptor, TCR), 키메릭항원수용체(chimeric antigen receptor, CAR) 세포치료제 등이 있다.
최근 유전자 재조합 변형을 이용하여 인위적으로 암세포와 특이적으로 반응하는 키메라 항원 수용체를 장착시킨 T세포(CAR-T 세포)를 생산하여 암 환자에게 주입함으로써, 정상세포가 아닌 암세포에 면역반응을 증진시켜 사멸하게 하는 새로운 면역치료법이 개발되었다.
2010년 이후, CART세포를 치료제로 이용한 임상시험의 결과들이 차례로 나오고 있으며 이들 대부분이 환자들에게서 좋은 효과를 보이고 있다. 이로 인해 기존의 면역치료가 갖는 여러 문제점들을 해결 할 수 있는 ‘차세대 암 치료제’로 대두되고 있다. 여기서는 CAR-T 세포를 이용한 암 면역치료에 대해 자세히 살펴보고자 한다.
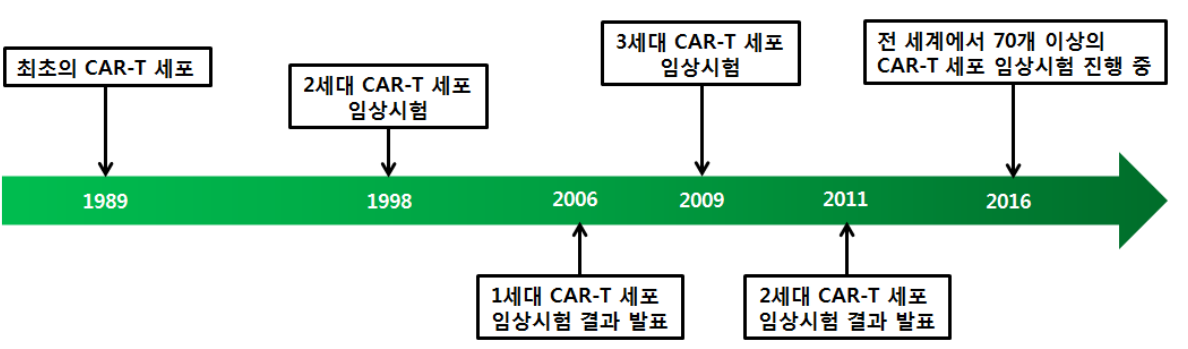
최초의 CAR-T 세포치료제인 킴리아 주(KymriahⓇ, 성분명: tisagenlecleucel)는 2017년 미 FDA에서 ‘난치성 B 세포 전구체 급성림프구성백혈병의 치료’에 성인과 소아에도 승인되었다. 이어 두번째 CAR-T 세포 치료제인 예스카타 주(YescartaⓇ, 성분명: axicabtagene ciloleucel)도 ‘미만성 거대 B 세포림프종’)에 승인되 었다.
키메라 항원 수용체(Chimeric Antigen Receptor, CAR) 란?
1980년대 이스라엘의 Weizmann Institute of Science의 화학자이면서 면역학자인 Dr. Zelig Eshhar와 그의 동료들은 암세포에서 특이적으로 발현하는 항원과 결합하는 수용체를 갖는 T세포를 인위적으로 만들면, 암세포만 표적(Target)하여 면역반응을 일으켜 암세포를 죽일 수 있다는 이론을 생각한다.
여기서 이들이 선택한 T세포는 우리 몸 안에 침입자를 공격하는 역할을 하는데, 침입자가 갖고 있는 특정 항원을 인지하여 그 항원을 갖고 있는 세포를 사멸시키는 역할을 담당하고 있다.
결국 이들은 키메라 항원 수용체(Chimeric Antigen Receptor, CAR)를 장착한 T세포를 만드는데 성공하였고 이를 1989년 PNAS에 발표한다
(출처: Trends Mol Med. (2012) 18(7):377-384)
하지만, 처음 CAR-T 세포를 고안한 논문이 발표되고 20여 년이 넘도록 T세포를 이용한 면역치료는 임상적으로 성공하지 이루지 못했다.
그 이유는 초창기에 만든 1세대 CAR-T 세포는 CD3ζ 유전자만 갖고 있었는데, 여러 가지 암세포 항원들과 반응하는지 실험해 보았지만 약효가 미미했고 지속 능력도 좋지 않았다.
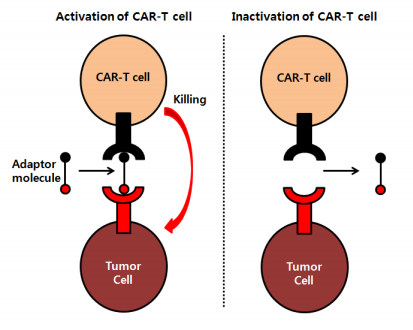
그러나 2011년, 펜실베니아대학교의 면역학 교수인 Carl June와 Bruce L. Levine 교수는 암을 겨냥하는 항체(악성 B세포 특이항원 CD19을 인식하여 결합하게 함)와 T세포의 반응을 증폭시키는 수용체(T세포 보조자극 수용체 CD137 or 4-1BB, 그리고 T세포 항원수용체의 신호전달요소인 CD3ζ)를 결합한 새로운 개념의 2세대 CAR-T 세포를 설계하여 1세대가 갖고 있던 한계를 극복하고자 하였다.
그 결과, 몸 안에서 CAR-T 세포들이 약 천 배가 넘는 숫자로 증식하는 놀라운 성과를 얻게 된다. 단, 이 당시 유전자 재조합 된 T세포는 악성 B세포뿐만이 아니라 일부 정상적인 B세포도 살해했기 때문에 환자들은 정기적으로 정상적인 B세포를 함께 주입 받아야 했다.
(출처: CANCER RESEARCH Catalyst 2016. 4. 27 게재)
CAR-T 세포 구조와 제조 방법
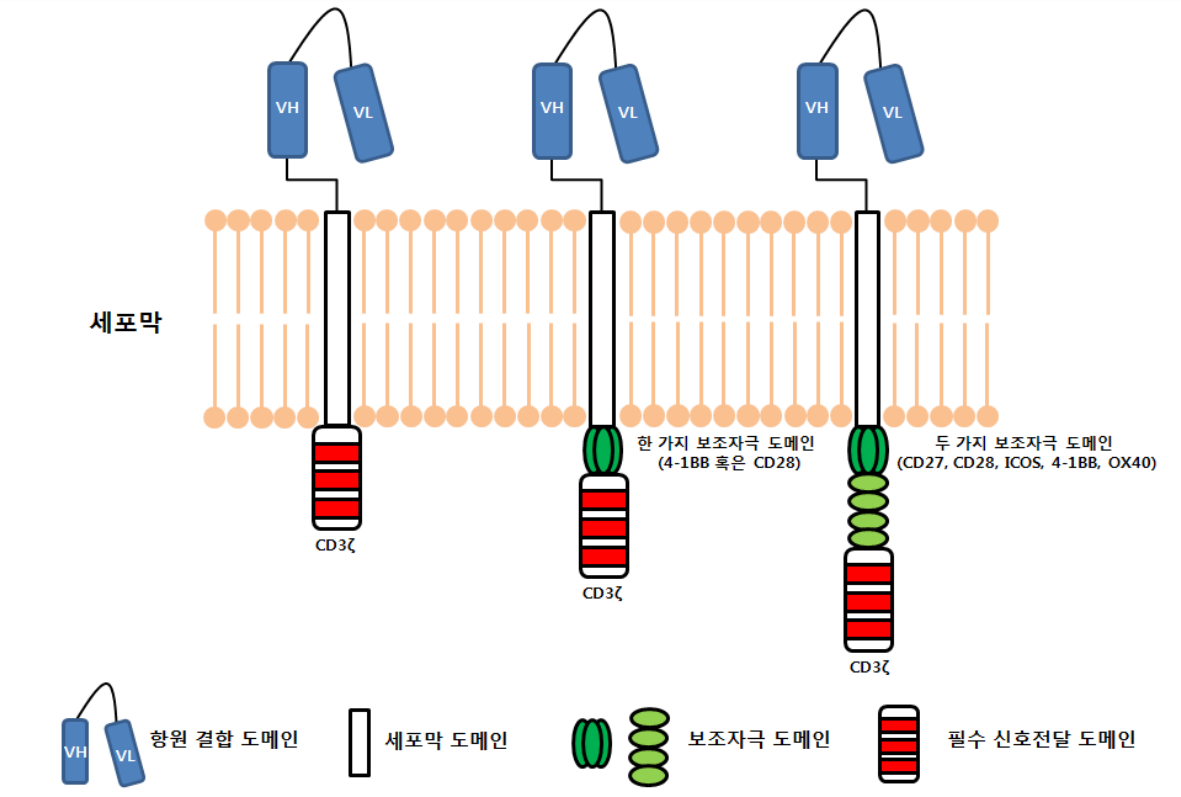
CAR-T 세포는, 암세포를 항원으로 인식하는 수용체 유전자를 도입한 유전자 재조합 된 T세포로 다음과 같은 모듈식 디자인으로 된 합성 폴리펩타이드로 이뤄져 있다.
(출처: Blood. (2014) 123(17):2625-2635)
이러한 구조의 CAR-T 세포는 1세대, 2세대, 3세대 등 세대가 지남에 따라 세포 내부의 보조자극신호(Co-stimulatory domain) 부분에서 CAR-T 세포의 자가 증식의 능력을 키우게 만들어 작은 세포 수를 주사해도 몸 안에서 암세포에 대항하는 CAR-T 세포들이 많이 만들어 내고, 주입 후에도 오랜 시간 체내에서 지속될 수 있도록 하는 유전자들(보조자극신호 도메인)로 재조합 되어 개발되고 있다.
즉, 1세대의 경우 보조자극신호 도메인이 CD3ζ 밖에 없어 신호 전달의 한계가 있었지만, 2세대, 3세대에는 이 도메인 부위에 CD28, 4-1BB, OX40 등이 추가되어 암세포 특이적 인식 능력을 향상시키고자 하였다.
그러나 체내 CAR-T 세포의 지속력의 한계와 부작용이라는 문제점이 남아있어, 이를 극복하기 위해 가장 최근 만들어지고 있는 3세대 CAR-T 세포는, 보조자극신호 역할을 하는 신호도메인 2개와 인공수용체(Additional engineered receptor)가 추가되어 ‘암세포 항원 인식 능력’이 높아져 정상세포를 공격하는 부작용을 최소화하고자 한다.
이와 같이 유전자 재조합 된 CAR-T 세포를 제조하여 암 환자에게 주입하기까지는 여러 단계를 거치게 된다. CAR-T 세포를 만드는 방법으로 환자의 혈액에서 백혈구성분분리채집(Leukapheresis) 과정을 거쳐 T세포를 추출한 뒤(Selection & Activation), 바이러스 벡터(Retro-/Lentivirus Vector)를 이용하여 암세포 특이적 키메릭 항원 수용체(Chimeric Antigen Receptor, CAR)로 디자인된 DNA를 T세포에 주입(CAR transduction)하고 이 세포를 증식(Expansion)시킨다.
이때 바이러스 사용에 대한 안전성과 잘 제작된 CAR-T 세포를 선별하는 기술이 요구되며, 마지막으로 만들어진 CAR-T 세포를 다시 환자에게 주입(Infusion)하게 된다.


(출처: Mol Cancer. 2014. 13:219)
CAR T-Cells Therapy의 장점
• HLA 독립적 항원 인식, 보편적 적용
• CD4 + 및 CD8 + T- 세포에서 모두 활성화
• 표적 항원에는 단백질, 탄수화물 및 당지질이 포함됩니다.
• 종양 특이 적 T- 세포의 빠른 생성
•자가 면역 또는 GVHD의 최소 위험
• 생약, 단일 주입
출처: Chimeric Antigen Receptor(CAR)를 이용한 암 면역치료- 홍 성 혜
'Reference > Immunology' 카테고리의 다른 글
| T 세포 (0) | 2019.09.09 |
|---|---|
| 면역치료 정의, 면역치료 역사, 면역치료 종류 (0) | 2019.09.09 |
| 면역세포의 종류; 우리몸을지키는군대, 면역시스템에는 어떤 세포들이 있을까요? (0) | 2019.08.29 |
| rh 혈액형(Rh Blood Group) (0) | 2019.08.02 |
| 혈액형 검사 ABO typing 이해하기 쉽게 설명, 혈액형을 맞추어 수혈을 해야 하는 이유, 혈액형 실험 (0) | 2019.07.29 |



