면역치료
수십 년 동안 암을 치료하는 방법들은 꾸준히 변화하고 발전해왔다.
1800년대에서부터 1900년대까지는 외과적인 수술(Surgery), 화학요법(Chemotherapy), 그리고 방사선 요법(Radiation therapy)과 같은 방법들이 주로 이뤄졌지만, 이들에 대한 한계점들이 드러나기 시작했다.
가장 대표적인 예로는 기존 치료 방법들은 암이 전이되지 않는 초기의 경우에만 효과가 있으며, 이미 전이가 진행된 상태라면 외과적인 수술 후에도 재발의 가능성이 높게 나타났다.
또한, 화학요법은 고형암(Solid tumor)에서는 치료 효과가 낮고, 암세포 이외의 정상세포의 성장도 함께 억제시키는 부작용(Side effect)을 야기시켜 많은 환자들이 치료 중 고통을 겪기도 한다.

그래서 연구자들은 효과가 좋으며 부작용이 적은 암 치료방법을 오랫동안 찾고자 노력했다.
그 결과, 정상세포가 아닌 암세포의 특정물질에 반응하는 표적 치료제 (Targeted drugs)를 이용한 치료법을 고안하게 된다.
하지만, 이 방법은 매우 특이적 특징(표적 유전자의 변이 혹은 발현 여부 등)을 갖는 암세포들의 경우에만 치료가 가능하고 치료비용이 비싸며 장기투여 시 내성이 발생되기도 한다.
이러한 기존 치료 방법들의 한계를 뛰어넘고자 최근 항암면역치료 방법에 대한 연구가 활발히 진행 중이다.
면역치료(Immunotherapy)란, 체내 면역세포들의 특성들을 이용하여 부작용을 최대한 줄이며, 환자의 몸이 암세포와 맞서 싸우도록 면역반응을 강화시키는 치료방법이다.

(출처: Nat. Rev. Clin.Oncol. (2014) 11, 509–524)
면역치료의 역사
사실, 면역치료를 암 치료방법으로 쓰기 위한 연구를 시작한지는 오래되었다.
1884년 미국 뉴욕에 있는 Memorial Hospital의 외과의사인 William B. Coley는 자신의 환자들 중 한 남성이 박테리아에 감염이 되었는데, 그의 암세포에서 괴사현상(Necrosis, 신체 조직이나 세포가 부분적으로 죽어서 썩음)이 일어나는 것을 발견한다.
얼마 후 그 환자는 건강한 모습으로 퇴원을 했고 1891년까지 암이 재발되지 않았다.
그 뒤 Coley박사는 여러 종류의 박테리아들을 인위적으로 배양하여 “Coley’s Toxins”이라 불리는 배양액을 43년 동안 외과적인 수술이 어려운 1,000여명의 암 환자들에게 주입하여 암을 치료한다.
그 결과 일부 환자에게서(10%) 암세포가 사멸되는 것이 관찰 되었지만, 대부분의 환자에게서는 부작용이 심하게 발생되어 암 치료방법으로 적합하지 않다고 판단되었다.
수십 년이 지난 뒤, 박테리아가 암을 치료한 것이 아니라 우리 몸에서 반응하는 면역체계 중 대식세포가 박테리아의 침입으로 활성화 되면서 여러 물질들을 분비하는데, 이 분비 물질들이 박테리아를 죽임과 동시에 암세포도 함께 사멸 시켰다는 것을 알게 되었다. 그 뒤 1909년, Paul Ehrlich 박사는 “면역체계가 암세포의 발생을 억제한다”는 이론을 제시한다.
그의 이론은 추후 면역감시체계(Immune surveillance)라는 이론의 시초가 되는데 이는, 인간의 면역체계가 생체 내에서 암세포의 발생을 감지하고 인지하며 이를 제거한다는 이론으로 F. Macfarlane Burnet과 Lewis Thomas 박사에 의해 1949년 발표된다.
당시 이 이론은 큰 반향을 일으켰고, 면역세포들이 인식할 수 있는 암세포 특이적 항원을 발견하기 위해 많은 연구들이 진행되어 암 면역치료에 대한 관심이 높아지게 된다.
그러나 면역감시체계 이론은 실험적으로 증명되지 못했고, 1980년대 중반까지 암 면역치료는 연구자들과 의사들로부터 외면을 받게 된다.
하지만, 생명과학의 전반적인 발전과 다양한 유전공학적 기술들이 개발됨에 따라 암 면역치료법에 대한 가능성이 다시 재기된다.
대표적으로 재조합 DNA기술은 순수 사이토카인(Cytokine)의 생산을 가능하게 했으며, 백신이 만들어지기도 했다.
그 뒤 유전자 변형, 조합 기술 등의 개발들로 인해 기존의 치료 방법들의 한계를 뛰어 넘을 수 있다는 기대와 함께 새로운 암 면역치료법으로 다시 관심을 받기 시작한다.
이러한 면역치료법은 개인의 항체와 림프구를 능동적으로 생산하게끔 하는 ‘능동면역’과 다른 사람이나 혹은 동물의 신체 내에서 이미 만들어진 면역반응 성분을 투여 받는 ‘수동면역’ 방법으로 나눠진다.
*항원: 외부로부터 침입한 바이러스, 박테리아 등에 의해 생성되는 면역 반응을 일으키거나 항체를 만들도록 하는 물질
*항체: 체내로 들어온 항원에 대항하여 만들어지는 물질
*항원항체반응: 항원과 이것에 대응하는 항체 사이에 생기는 면역반응

면역치료분류

면역관문억제제(Immune checkpoint inhibitors):
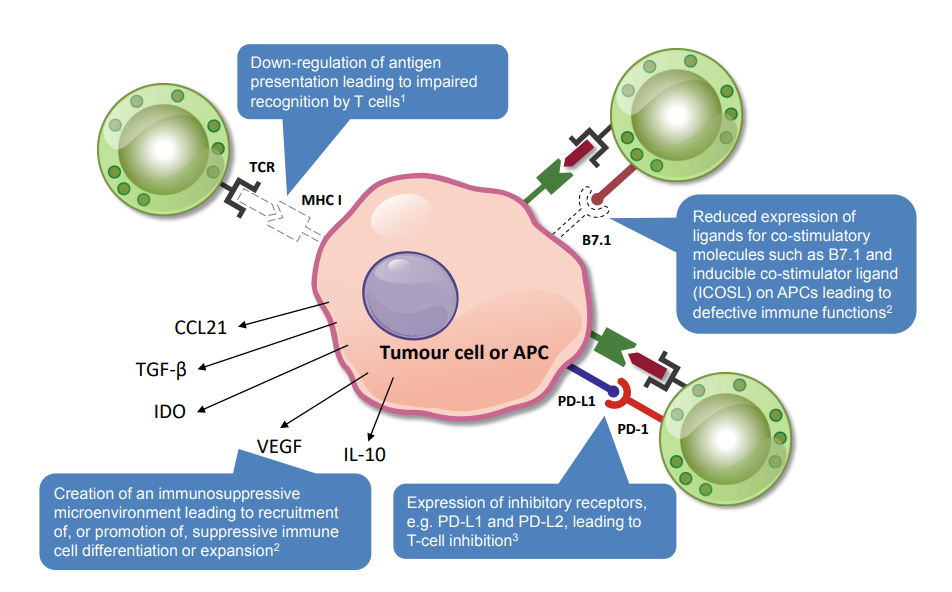
암세포들은 경찰을 피하기 위해 위장을 하는 범인처럼, 스스로 여러 단백질들(Immune checkpoint target)을 만들어 우리 몸 안에서 면역반응이 일어나지 않도록 막는다.
이러한 물질들이 만들어 지지 않도록 방해하는 저해제(Inhibitor)를 암세포에 처리하여 정상적으로 면역세포들이 면역반응을 갖게 하는 치료 방법이다(예, 비엠에스(BMS, 미국)-옐보이(Yervoy: CTLA-4 저해제), 머크(Merck, 독일)- 키트루다(Keytruda: PD-1/PD-L1 저해제) .

항암 백신(Anticancer vaccines):
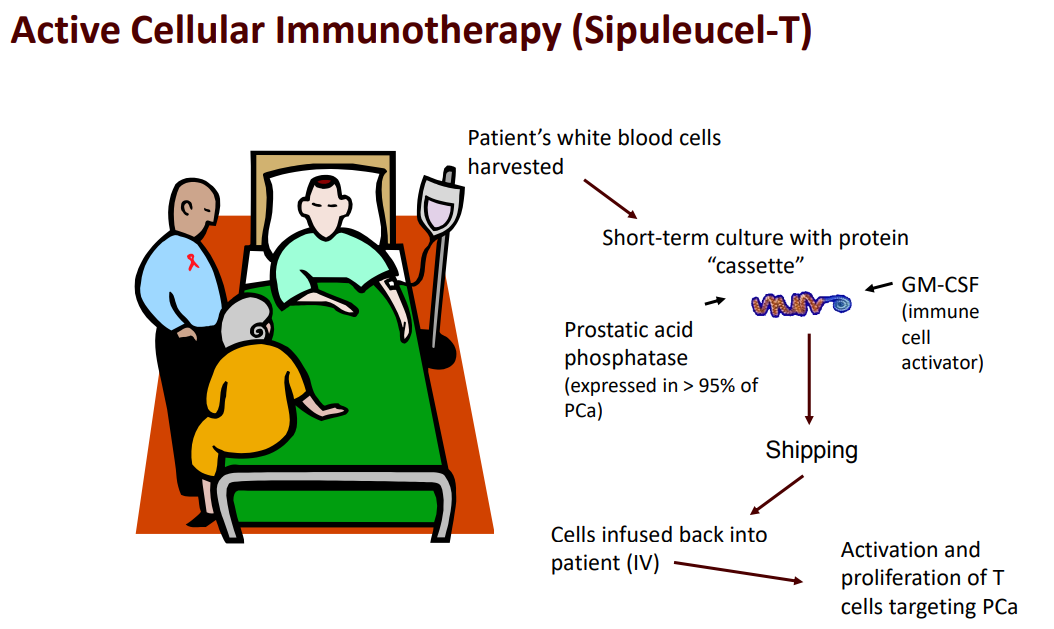
암세포가 갖고 있는 암-특이적 항원(Tumor-specific antigen)을 암환자에게 투여하여 면역체계를 활성화시킴으로써 생체 내 면역기능이 활발하게 만들어 암세포를 공격하도록 하는 능동적 면역치료 방법이다.
암세포의 특정 항원을 대상으로 하여 암세포 특이적 면역반응을 유도하는 “특이적 항암치료백신”(예, 펩타이드 백신, DNA 백신, 바이러스 백신/ 인유두종바이러스(HPV) 백신 등)과 생체내의 전반적인 면역반응을 향상시켜 암을 치료하고자 하는 “비특이적 항암치료백신”(예, B7 그룹, TNF 그룹, 사이토카인 그룹 등)으로 나눌 수 있다.
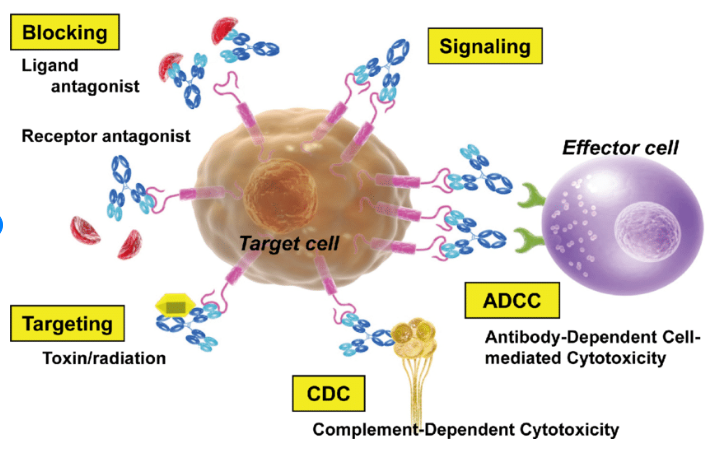
항체치료제(Therapeutic antibodies)
정상세포와 암세포 모두에게 독성을 주는 화학요법에서 사용되는 약물과는 달리, 종양 세포의 표면에 있는 특정 항원에 결합하여 전신 독성을 낮추고자 만든 치료제이다.
하지만 이 치료제도 소수의 암에서만 치료가 가능하다는 단점을 갖고 있다.
이들 치료용 항체들 중 일부는 항체치료제만의 단점을 보완하고자 암세포들을 파괴하기 위해 항체-약물 결합체(Antibody–drug conjugates, ADCs)로 디자인되어 만들어졌다.
항체-약물 결합체의 항체는 암세포의 표면에 발현되는 표적분자에 반응하도록 만들어졌으며, 암세포가 약물인 독성물질(Toxic substance)에 노출되어 사멸하게 만드는 치료법이다.
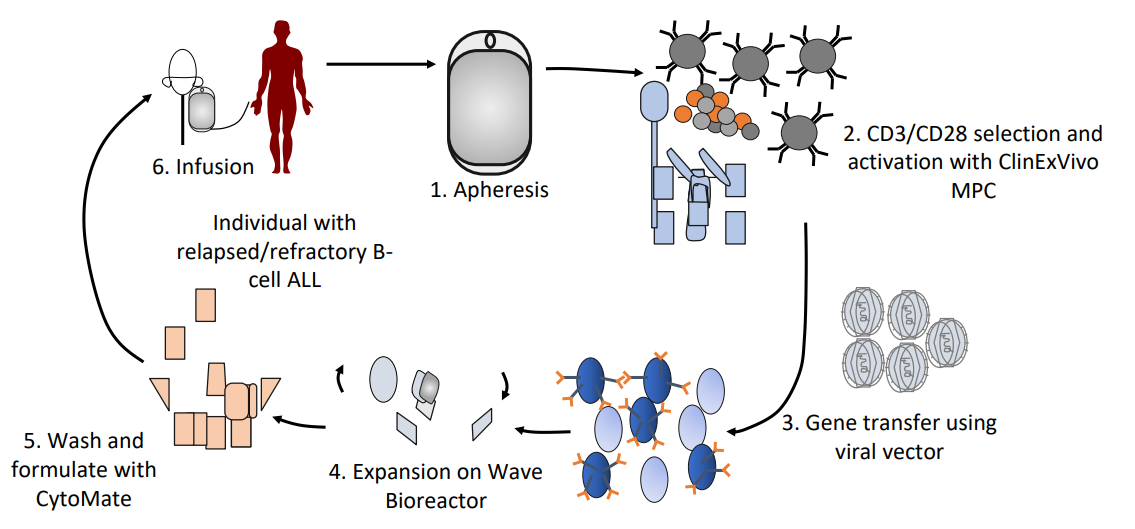
면역세포요법(Immune cell therapy):
체내의 면역세포를 꺼내서, 강화시키거나 유전공학적으로 변형시켜 다시 넣어주는 세포치료 방식이다.
이를 입양세포치료제(Adoptive Cell Transfer, ACT)이라고 부르는데, 대표적으로 암세포에 대한 세포성 면역을 강화시키는 방법으로 종양 침윤 림프구(Tumor Infiltrating Lymphocytes, TIL), 키메릭 항원 수용체(Chimeric Antigen Receptor, CAR), T세포 수용체(T-Cell Receptor, TCR) 기술 등이 있다.
출처:BRIC View 2016-T09
'Reference > Immunology' 카테고리의 다른 글
| 주조직적합복합체(MHC) 면역계의 수호자 (0) | 2024.08.29 |
|---|---|
| T 세포 (0) | 2019.09.09 |
| 면역세포치료란 무엇인가? 기초부터 이해하기 / CAR T-Cells Therapy의 장점 (0) | 2019.09.09 |
| 면역세포의 종류; 우리몸을지키는군대, 면역시스템에는 어떤 세포들이 있을까요? (0) | 2019.08.29 |
| rh 혈액형(Rh Blood Group) (0) | 2019.08.02 |



